STOCKHOLM (Direkt) Det finländska hälsoteknikbolaget Bioactive Bone Substitutes (BBS), som utvecklar bioaktiva bentransplantatssubstitut för medicintekniska produkter, har som största utmaning att komma ut på marknaden med sin produkt som i stort sett är redo.
Det säger BBS vd Pekka Jalovaara i en intervju med Nyhetsbyrån Direkt inför bolagets listning på Nasdaq First North onsdagen den 28 februari.
Företaget grundades 2003 av honom och den finska Elecster-grundaren Tuomo Halonen.
Vad kan man uppnå med BBS behandling?
“Den är ett substitut för egen benvävnad ifall man har problem med läkning. Produkten är baserad på protein från renars ben. Benen kommer från Rovaniemi rensslakteri som ägs av av Polarica från Haparanda.”
Appliceras produkten en gång eller flera?
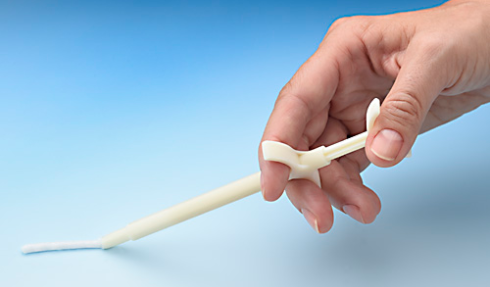
“Den appliceras bara en gång. Det sker under operation. Implantatet är i krämform i en spruta färdig för användning. Om man exempelvis har en fraktur som inte läker brukar man ta sin egen benvävnad från vissa delar av kroppen. Med vår produkt behöver man inte ta sin egen benvävnad, vilket sparar ungefär en timmes operationstid. Det finns flera andra produkter som syftar till samma sak, men ingen är idealisk. Vår produkt är ‘nästa generations lösning'”, säger Pekka Jalovaara.
Går läkningen snabbare med er produkt?
“Vi försöker inte snabba på läkeprocessen, men däremot säkerställa att den äger rum. Det är bra om läkeprocessen är fysiologisk och går så normalt som möjligt.”
Vilka medicinska tillstånd kan ni behandla?
“De vanligaste patienterna har bendefekt eller benläkningsstörning och saknar eget ben för transplantation.”
Foto: BBS implantatspruta. Bildkälla: BBS
Hur stor är marknaden?
"Globalt genomförs flera miljoner operationer av den här typen per år. Marknadsstorleken är enorm och uppgår till 2,5-3 miljarder dollar, men ändå används främst gamla metoder såsom egen benvävnad. Marknaden växer samtidigt 5-7 procent årligen. Framför allt den unga generationens kirurger vill snabba på operationsprocessen. Att använda egen benvävnad tar omkring 45-60 minuter extra."
Hur ser konkurrensbilden ut?
"Marknadsledarna har varit två produkter som båda är baserade på ett enda tillväxtfaktorprotein, så kallad rekombinant-protein. Det innebär att de har skapats artificiellt i celler. Det finns dock omkring 20 bentillväxtfaktorer i kroppen - att bara använda en i enorma mängder är ofysiologiskt och har orsakat problem. Deras försäljning har sjunkit dramatiskt. Den andra konkurrenten är produkter som baseras på mänskligt ben från mänskliga donatorer. Den metoden lever dock inte upp till alla krav. Bland annat är det svårt att öka antalet donatorer."
Enligt Pekka Jalovaara är marknaden stor och växande.
"Det finns stort utrymme för vår typ av produkt. Benprotein från renar utgör 1 procent av vårt implantat. Det innehåller därtill ett naturligt spektrum av tillväxtfaktorer, vilket gör att vi skiljer oss från rekombinant-produkterna som bara har en tillväxtfaktor."
Vilket pris tänker ni sätta på produkten?
"Vi räknar med att ta ut cirka 1.000 euro per implantat (ca 10.000 svenska kronor). Det är ett acceptabelt pris för sjukhuset eftersom de sparar pengar genom minskad operationstid", säger BBS-chefen som även framhåller att många konkurrerande produkter kräver blandningsmoment medan BBS produkt kan användas direkt.
Var ligger konkurrenternas priser?
"Rekombinant-produkterna är ganska dyra - flera tusen euro beroende på land. I Finland kostar de cirka 3.000 euro. De andra konkurrenterna ligger prismässigt ungefär där vi avser ligga."
Är ert patentskydd starkt nog? Finns det risk för konkurrens från kopior?
"Vi har en bra patentportfölj som skyddar implantatet och produktionen. Därutöver har vi patent på vissa tillväxtfaktorer för rensben. Sedan har vi företagshemligheter i produktionsfaciliteten. Det tar rätt lång tid att bygga upp produktionskapacitet - det tog oss ungefär tre och ett halvt år."
Pekka Jalovaara framhåller att BBS har en egen produktionsfacilitet som redan har certifierats för produktion av renproteiner. Han anser att anläggningen utgör en av bolagets huvudsakliga fördelar.
"Vi kan redan nu sälja protein om någon skulle vilja ha. Många företag i denna fas som har allt redo för CE-märkning saknar egen produktion."
Kapaciteten i produktionslinan är 25.000 implantat/år.
Vilka kunder avser ni sälja till?
"Vi säljer direkt till sjukhus. Kunderna är kirurger som arbetar med ben."
Hur ska ni nå dem?
"Vi ska nå dem genom vår egen marknadsdirektör och tre säljare. I sjukhusen har vi så kallade produktspecialister, exempelvis sjuksköterskor som arbetar på uppdrag av oss. Vi börjar i tre-fyra centraleuropeiska länder och har sammantidigt direktförsäljning i de nordiska länderna.
När inleds försäljningen?
"Vi har gjort all produktutveckling, djurstudier och även kliniska studier. Vår process för att erhålla CE-märkning pågår", säger BBS-chefen och beskriver det som att bolaget är mycket nära att vara redo för marknaden.
Ni har gjort tester på människor också?
"Ja, i ankeln."
Var produkten effektiv där?
"Ja, den verkade fungera bra och var säker, vilket är de två faktorer man tittar på."
Har er behandling några biverkningar?
"Den har varit säker i djurtester och i kliniska tester. Djurbaserade proteiner finns i många andra produkter och orsakar i sig inga biverkningar. Celler och cellmembran kan innebära utmaningar, men proteiner är mycket väl tolererade."
Var avser ni sälja produkten geografiskt?
"Under första året siktar vi på CE-godkännande i Europa. Den största marknaden är sedan USA. Vi har en pågående process för att erhålla godkännande av den amerikanska myndigheten FDA. Senare kan man även tänka sig länder som Kina, Japan, Indien, Australien och Ryssland. Godkännandeprocessen ser olika ut i olika länder, men när vi har CE-märkning kommer det vara lätt att få godkännande i många länder. Vissa länder såsom Kina kan dock kräva ytterligare tester."
När tror ni att ni kan få CE-märkning i Europa?
"Vi förväntar oss att få det i år eller början av 2019."
Vad har ni för tidsperspektiv på FDA-processen?
"Vi behöver göra vissa djurtester, men de flesta krav uppfyller vi redan. Vi gör ansökan parallellt med CE-ansökningsprocessen. Jag tror att vi kan få FDA-godkännande i slutet av 2019 om allt går bra."
Vilka är era huvudsakliga utmaningar för att nå era mål?
"För närvarande är vår största utmaning marknadsområdet. De stora spelarna på benimplantats- och medicinteknikområdet har sällan egen forskning och utveckling, utan är tjänsteföretag som har bra marknadsnätverk. Det innebär att de blir intresserade när de ser att en produkt är framgångsrik. Det är så den här marknaden fungerar."
Kan de bli intresserade av er produkt?
"Vi kan samarbeta med dem inom försäljning eller så kan de köpa upp oss."
Så ni tittar efter samarbete med större aktörer?
"Ja, det kan vara användbart. Att bygga egna försäljningsnätverk är väldigt dyrt".
Är detta något ni kommer att spana efter redan från start?
"Ja, självklart. Vi har visserligen bara börjat bygga upp försäljningsavdelningen, men vi har kommit igång."
Har ni satt några finansiella mål?
"Ja naturligtvis, men att ge prognoser till investerare är svårt eftersom vi saknar försäljning i nuläget. När vi har fått i gång försäljningen kan vi överväga det."
Du har arbetat mycket med forskning och nu är företaget på väg in i en ny kommersiell fas. Hur säkerställer du att företaget har den marknadserfarenhet som krävs?
"Vi söker folk. Jag är professor i ortopedisk kirurgi och har förmågor inom utveckling, men marknadsföring är inte mitt fält. Vi måste naturligtvis förstärka personalstyrkan och även byta ut vissa personer".
Ni har omkring tolv anställda - hur stor är er årliga budget?
"Hittills ungefär 1,5-1,6 miljoner euro per år. Nu när vi går in i kommersiell fas behöver budgeten öka till i storleksordningen 2-2,5 miljoner euro."
Hur länge kommer de pengar ni nu tar in räcka?
"Nasdaqs krav säger minst ett år. Vi får se hur mycket vi får in."
Efter att intervjun gjordes har bolaget meddelat utfallet att nyemissionen tecknades till drygt 45 procent och tillför 3,5 miljoner euro före emissionskostnader.
Ni kommer till aktiemarknaden i hyfsat turbulenta tider. Är det svårt att komma till marknaden nu?
"Ja, det är ganska svårt, men man kan inte välja rätt datum. Måndagen häromveckan var rätt turbulent i Finland och det gör det svårt, men jag tror att vi kan hantera det ändå. Men visst, det var den första turbulensen på ett och ett halvt år."
Varför vill ni vara listade både i Finland och Sverige?
"I Finland finns det ganska få medicinteknikbolag och de är inte särskilt kända om man jämför med hur det ser ut i Sverige. Därtill har Sverige många investerare och är en möjlig marknad för vår produkt."
Vilka viktiga händelser eller milstolpar väntar för BBS framöver? Vad ska man spana efter som investerare?
"CE-märkningen av produkten och certifieringen av produktionen, vilket är en del av CE-märkningen."
Under hur många år tror du att ert produkterbjudande kan vara relevant på marknaden?
"Den här typen av produkter har mycket lång livscykel. När jag började studera på 1960-talet fanns det en kollagenprotein-produkt som användes i samband med blödningar - den produkten finns fortfarande på marknaden och kan användas. Det är inte som inom IT-sektorn där produkter fort blir omoderna."
Teckningskursen i nyemissionen var 5:50 euro per aktie.